Как найти объем по химии 🚩 газ формула химия 🚩 Естественные науки
Автор КакПросто!
Есть множество формул для нахождения объема. В первую очередь необходимо определить в каком агрегатном состоянии находится вещество, для которого мы ищем объем. Для объема газа подходят одни формулы, а для объема раствора совершенно другие.

Статьи по теме:
Инструкция
Одна из формул объема раствора: V = m/p, где V – объем раствора(мл), m – масса(г), p – плотность(г/мл). Если требуется дополнительно найти массу, то это можно сделать, зная формулу и количество нужного вещества. С помощью формулы вещества мы найдем его молярную массу, сложив атомные массы всех элементов, входящих в его состав. Например, M(AgNO3) = 108+14+16*3 = 170 г/моль. Далее находим массу по формуле: m = n*M, где m – масса(г), n – количество вещества(моль), M – молярная масса вещества(г/моль). Подразумевается, что количество вещества дано в задаче. Следующая формула для нахождения объема раствора выводится из формулы молярной концентрации раствора: с = n/V, где c – молярная концентрация раствора(моль/л), n – количество вещества(моль), V – объем раствора(л). Выводим: V = n/c. Количество вещества можно дополнительно найти по формуле: n = m/M, где m – масса, M – молярная масса. Далее приведены формулы для нахождения объема газа. V = n*Vm, где V – объем газа(л), n – количество вещества(моль), Vm – молярный объем газа(л/моль). При нормальных условиях, т.е. давлении равным 101 325 Па и температуре 273 К молярный объем газа является величиной постоянной и равен 22,4 л/моль.Для газовой системы существует формула: : q(x) = V(x)/V, где q(x)(фи) – объемная доля компонента, V(x) – объем компонента (л), V – объем системы (л). Из этой формулы можно вывести 2 другие: V(x) = q*V, а также V = V(x)/q.
Если в условии задачи присутствует уравнение реакции, решать задачу следует с помощью него. Из уравнения можно найти количество любого вещества, оно равно коэффициенту. Например, CuO + 2HCl = CuCl2 + h3O. Отсюда видим, что при взаимодействии 1 моля оксида меди и 2 моль соляной кислоты получилось 1 моль хлорида меди и 1 моль воды. Зная по условию задачи количество вещества всего одного компонента реакции, можно без труда найти количества всех веществ. Пусть, количество вещества оксида меди равно 0,3 моль, значит n(HCl) = 0,6 моль, n(CuCl2) = 0,3 моль, n(h3O) = 0,3 моль.
Обратите внимание
Не забывайте про единицы измерения!
Источники:
- «Сборник задач по химии», Г.П. Хомченко, И.Г. Хомченко, 2002.
- объем формула от массы
Масса любого вещества,молекулы равна сумме масс образующих ее атомов. Если при расчете использовать относительные атомные массы ,то получается относительная молекулярная масса вещества. Относительная молекулярная масса показывает во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода. Обычно используют приблизительные значения относительных атомных и молекулярных масс. Эти величины безразмерны.
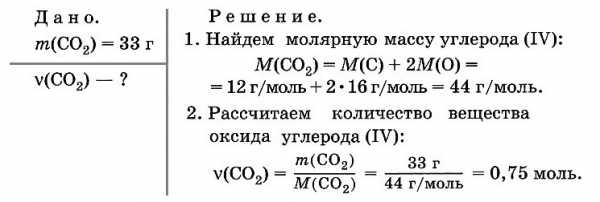
Инструкция
Подсчитайте в молекуле количество элементов.Например, молекула воды h3O состоит из двух атомов водорода и одного атома кислорода,а сульфат железа (III) Fe2(SO4)3 содержит два атома железа,три атома серы и двенадцать атомов кислорода. Подсчитайте,чему равна атомная масса каждого элемента в молекуле. Чтобы узнать относительную массу одного атома загляните в периодическую систему элементов.Порядковый номер и есть атомная масса. Также вы можете рассчитать ее по формуле Ar(элемента)=m(элемента)/1a.e.m. Для легкости расчетов используют приблизительные значения.Ar(H)=1?2=2;Ar(O)=16?1=16Ar(Fe)=56?2=112;Ar(S)=32?3=96;Ar(O)=16?12=192
Сложите полученные результаты.Это и будет молекулярная масса вещества.
Mr(h3O)=2Ar(H)+Ar(O)=2+16=18
Mr(Fe2(SO4)3)=2Ar(Fe)+3Ar(S)+12Ar(O)=112+96+192=400
Кроме относительной молекулярной массы при расчетах чаще используют молярную массу. Ее единица измерения — г/моль. Она численно равна относительной молекулярной массе вещества.
M(h3O)=18 г/моль
M(Fe2(SO4)3=400 г/моль
Видео по теме
В ходе химической реакции могут образоваться самые разные вещества: газообразные, растворимые, малорастворимые. В последнем случае они выпадают в осадок. Часто возникает необходимость узнать, какова точная масса образовавшегося осадка. Каким образом это можно вычислить?

Вам понадобится
- — стеклянная воронка;
- — бумажный фильтр;
- — лабораторные весы.
Инструкция
Можете действовать опытным путем. То есть, проведите химическую реакцию, тщательно отделите образовавшийся осадок от фильтрата с помощью обычной стеклянной воронки и бумажного фильтра, например. Более полное отделение достигается с помощью вакуумной фильтрации (на воронке Бюхнера).После этого осадок высушите – естественным путем или под вакуумом, и взвесьте с возможно большей точностью. Лучше всего, на чувствительных лабораторных весах. Вот так будет решена поставленная задача. К этому методу прибегают, когда неизвестны точные количества исходных веществ, вступивших в реакцию.
Если же вам известны эти количества, тогда задачу можно решить гораздо проще и быстрее. Предположим, необходимо вычислить, сколько хлористого серебра образовалось при взаимодействии 20 грамм хлористого натрия — поваренной соли — и 17 грамм азотнокислого серебра. Прежде всего, напишите уравнение реакции:NaCl + AgNO3 = NaNO3 + AgCl.В ходе этой реакции образуется очень мало растворимое соединение – хлорид серебра, выпадающий в виде белого осадка.
Подсчитайте молярные массы исходных веществ. Для хлористого натрия она примерно составляет 58,5 г/моль, для азотнокислого серебра – 170 г/моль. То есть, изначально по условиям задачи вы имели 20/58,5 = 0,342 моля хлористого натрия и 17/170 = 0,1 моля азотнокислого серебра.
Таким образом, получается, что хлористый натрий изначально был взят в избытке, то есть, реакция по второму исходному веществу пройдет до конца (прореагируют все 0,1 моля азотнокислого серебра, «связав» те же 0,1 моля поваренной соли). Сколько же образуется хлористого серебра? Для ответа на этот вопрос, найдите молекулярную массу образовавшегося осадка: 108 + 35,5 = 143,5. Умножив изначальное количество азотнокислого серебра (17 грамм) на соотношение молекулярных масс продукта и исходного вещества, получите ответ: 17* 143,5/170 = 14,3 грамма. Вот такова будет точная масса осадка, образовавшегося в ходе реакции.
Полезный совет
Разумеется, полученный ответ не очень точный, поскольку вы использовали в расчетах округленные значения атомных масс элементов. Если требуется большая точность, необходимо учесть, что атомная масса серебра, к примеру, равна не 108, а 107,868. Соответственно, атомная масса хлора не 35,5, а 35, 453 и т.д.
Источники:
- вычислите массу осадка который образовался при взаимодействии
В задачах по химии школьного курса, как правило, требуется вычислить объем для газообразного продукта реакции. Вы можете это сделать, если известно количество молей любого участника химического взаимодействия. Или найдите это количество из других данных задачи.

Вам понадобится
- — ручка;
- — бумага для записей;
- — калькулятор;
- — таблица Менделеева.
Инструкция
Прежде всего, составьте уравнение реакции. Возьмите для примера реакцию горения аммиака в кислороде с образованием азота и воды. Вам необходимо найти объем выделившегося газа N2. Проставьте коэффициенты в уравнении. Чтобы проверить себя, сосчитайте количество атомов одного элемента в левой и правой части уравнения. Обратите внимание, в каком соотношении химические соединения участвуют в реакции. Теперь, зная количество любого из участников реакции, вы можете определить, сколько молей азота образовалось.
Проставьте коэффициенты в уравнении. Чтобы проверить себя, сосчитайте количество атомов одного элемента в левой и правой части уравнения. Обратите внимание, в каком соотношении химические соединения участвуют в реакции. Теперь, зная количество любого из участников реакции, вы можете определить, сколько молей азота образовалось. 
Например, известно, что масса полученной воды, m(h3O), 72 грамма. Рассчитайте молярную массу воды. Для этого найдите в таблице Менделеева значения атомных масс элементов, составляющих молекулу, и сложите их: М(h3O) = 2*1 + 16 = 18 г/моль. Вычислите количество молей образовавшейся воды: v(h3O) = m(h3O)/M(h3O) = 72/18 = 4 моля.
Определите, сколько молей азота получилось, составив пропорцию: 6 моль Н2О — 2 моля N2; 4 моля Н2О – х моль N2. Решите уравнение, найдя х: х = 2*4/6 = 1,33 моль.
Согласно закону Авогадро, один моль любого газа в нормальных условиях, т.е. при температуре 0о и давлении 101325 Па, занимает 22,4 литра. Рассчитайте объем выделившегося 1,33 моля азота: V(N2) = 22,4*1,33 = 29,8 литра.
Если вы знаете, что в реакцию вступило, к примеру, 18 литров кислорода, воспользуйтесь законом объемных отношений Гей-Люссака. Он определяет, что объемы газов, участвующих в реакции, относятся друг к другу, как простые целые числа. То есть из уравнения реакции следует, что из трех литров O2 получается два литра N2. Вы можете сделать вывод, что из 18 литров кислорода образуется 12 литров азота.
Источники:
- вычислите продукт реакции н2 s
www.kakprosto.ru
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 413 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём
Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\Mr
n=V\22.4 (л\моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
_________________________________________________________________________________________________
Еще вам могут понадобиться:
- в ЕГЭ это вопрос А27
- А28
- задачи части С — 4 и 5
Категории: |
Обсуждение: «Основные формулы для решения задач по химии»
distant-lessons.ru
Как найти объем по химии
Есть уйма формул для нахождения объема. В первую очередь нужно определить в каком агрегатном состоянии находится вещество, для которого мы ищем объем. Для объема газа подходят одни формулы, а для объема раствора абсолютно другие.

Инструкция
1. Одна из формул объема раствора: V = m/p, где V – объем раствора(мл), m – масса(г), p – плотность(г/мл). Если требуется добавочно обнаружить массу, то это дозволено сделать, зная формулу и число необходимого вещества. С поддержкой формулы вещества мы обнаружим его молярную массу, сложив ядерные массы всех элементов, входящих в его состав. Скажем, M(AgNO3) = 108+14+16*3 = 170 г/моль. Дальше находим массу по формуле: m = n*M, где m – масса(г), n – число вещества(моль), M – молярная масса вещества(г/моль). Подразумевается, что число вещества дано в задаче.
2. Дальнейшая формула для нахождения объема раствора выводится из формулы молярной концентрации раствора: с = n/V, где c – молярная насыщенность раствора(моль/л), n – число вещества(моль), V – объем раствора(л). Выводим: V = n/c. Число вещества дозволено добавочно обнаружить по формуле: n = m/M, где m – масса, M – молярная масса.
3. Дальше приведены формулы для нахождения объема газа. V = n*Vm, где V – объем газа(л), n – число вещества(моль), Vm – молярный объем газа(л/моль). При типичных условиях, т.е. давлении равным 101 325 Па и температуре 273 К молярный объем газа является величиной непрерывной и равен 22,4 л/моль.
4. Для газовой системы существует формула: : q(x) = V(x)/V, где q(x)(фи) – объемная доля компонента, V(x) – объем компонента (л), V – объем системы (л). Из этой формулы дозволено вывести 2 другие: V(x) = q*V, а также V = V(x)/q.
5. Если в условии задачи присутствует уравнение реакции, решать задачу следует с подмогой него. Из уравнения дозволено обнаружить число всякого вещества, оно равно показателю. Скажем, CuO + 2HCl = CuCl2 + h3O. Отсель видим, что при взаимодействии 1 моля оксида меди и 2 моль соляной кислоты получилось 1 моль хлорида меди и 1 моль воды. Зная по условию задачи число вещества каждого одного компонента реакции, дозволено без труда обнаружить числа всех веществ. Пускай, число вещества оксида меди равно 0,3 моль, значит n(HCl) = 0,6 моль, n(CuCl2) = 0,3 моль, n(h3O) = 0,3 моль.
Объем – это количественная колляция, указывающая, какое именно пространство занимает то либо иное вещество (тело). В системе СИ объем измеряется в кубических метрах. Как же дозволено обнаружить объем какого-либо вещества?

Инструкция
1. Проще каждого – если вам вестима точная масса этого вещества (М) и его плотность (?). Тогда объем находится в одно действие, по формуле:V = M/?.
2. Можете воспользоваться способом, открытым еще в глубокой древности эпохальным ученым Архимедом. Наверно вам знаменита история, как сиракузский царь Гиерон, заподозрив своего ювелира в мошенничестве, приказал Архимеду определить, из чистого ли золота сделана его корона либо же в сплав подмешаны недорогие примеси. Казалось бы, все примитивно: вестима точная масса короны, знаменита плотность чистого золота. Но перед ученым встала задача: как определить объем короны, если она дюже трудна по форме? Архимед блестяще решил ее, взвесив корону вначале в воздухе, а потом в воде.
3. Разница в весе – так называемая «выталкивающая сила», равная весу воды в объеме короны. Ну а зная плотность воды, определить объем нетрудно. Действуя по аналогии, дозволено определить объем всякого твердого вещества, разумеется, если оно не растворяется в воде и тем больше не вступает с ней в реакцию.
4. Если вы имеете дело с газом, находящимся при условиях, близких к типичным, то определить его объем дюже примитивно. Нужно лишь запомнить, что один моль всякого газа при таких условиях занимает объем, равный 22,4 литра. Дальше дозволено изготавливать вычисления, исходя из данных вам условий.
5. Скажем, нужно определить, какой объем занимает 200 грамм чистого азота? Раньше каждого припомните формулу молекулы азота (N2) и ядерный вес азота (14). Следственно, молярный вес азота: 28 грамм/моль. То есть в 22,4 литра содержалось бы 28 грамм этого газа. А сколько будет его в 200 граммах? Вычислите: 200х28/22,4 = 250 грамм.
6. Ну, а как обнаружить объем газа, если он находится не при типичных условиях? Здесь вам придет на подмога уравнение Менделеева-Клапейрона. Хоть оно выведено для модели «безупречного газа», вы абсолютно можете им воспользоваться.
7. Зная такие нужные вам параметры, как давление газа, его массу и температуру, вы вычислите объем по формуле:V = MRT / mP, где R – универсальная газовая непрерывная, равная 8,31, m – молярная масса газа.
Полезный совет
Переведите все величины в одну систему, напротив получится бессмыслица.
Обратите внимание!
Не забывайте про единицы измерения!
jprosto.ru
Формула объема в химии
В химии, равно как и в физике очень важным является понятие объема, поскольку для решения задач, связанных с газообразными веществами, приходится оперировать именно этой величиной.
а) Закон Авогадро, молярный объем газа
Поскольку газы являются наиболее простым объектом для исследования, то их свойства и реакции между газообразными веществами изучены наиболее полно.
Французский ученый Ж. Л. Гей-Люссак установил закон объемных соотношений: объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа. Например, при взаимодействии 1 л хлора с 1 л водорода будет образовываться 2 л хлороводорода и т.д.
Этот закон позволил итальянскому ученому А. Авогадро предположить, что молекулы простых газов состоят из двух одинаковых атомов (водород, кислород, азот и др.). Изучение свойств газов позволило ему высказать гипотезу, которая впоследствии получила экспериментальное подтверждение и стала называться законом Авогадро:
Vm = V / n
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Примеры решения задач
ru.solverbook.com
Как найти объем раствора 🚩 масса раствора формула 🚩 Естественные науки
Автор КакПросто!
Существует несколько формул для нахождения объема раствора. В зависимости от того, что дано в условии задачи, можно выбрать одну из них. Порой данных в задаче недостаточно, и приходится применять дополнительные формулы для их нахождения.

Статьи по теме:
Инструкция
Одна из наиболее часто используемых формул выглядит так: V = m/p, где V — объем, m — масса(г), p — плотность(г/мл). Соответственно, если даны эти величины, можно без труда найти объем. Иногда бывает так, что не дана масса вещества, но дано количество вещества (n) и указано, какое это вещество. В этом случае массу находим по формуле: m = n*M, где n — количество вещества (моль), а M — молярная масса(г/моль). Лучше всего рассмотреть это на примере задачи. Количество вещества раствора сульфата натрия равно 0,2 моль, а плотность — 1,14 г/мл, найти его объем.Сначала пишем основную формулу для нахождения объема: V = m/p. Из этой формулы по условию задачи мы имеем только плотность (1,14 г/мл). Находим массу: m = n*M. Количество вещества дано, осталось определить молярную массу. Молярная масса равна относительной молекулярной массе, которая в свою очередь складывается из относительных атомных масс простых веществ, входящих в состав сложного. На самом деле все просто: в таблице Менделеева под каждым веществом указывается его относительная атомная масса. Формула нашего вещества Na2SO4, считаем. M (Na2SO4) = 23*2+32+16*4=142 г/моль. Подставляем в формулу, получаем: m = n*M = 0,2*142 = 28,4 г. Теперь полученное значение подставляем в общую формулу: V = m/p = 28,4/1,14 = 24,9 мл. Задача решена.Бывают еще другие типы задач, где присутствует объем раствора – это задачи на концентрации раствора. Формула, необходимая для нахождения объема раствора, выглядит так: V = n/c, где V – объем раствора(л), n – количество растворенного вещества(моль), c – молярная концентрация вещества(моль/л). При необходимости найти количество растворенного вещества, это можно сделать по формуле: n = m/M, где n – количество растворенного вещества(моль), m – масса(г), M – молярная масса(г/моль).
Обратите внимание
Единицы измерения данных величин должны соответствовать друг другу. Например, если масса дана в кг, то соответствующий ей объем измеряется в литрах. А если масса в г, то объем в мл.
Полезный совет
Всегда внимательно читайте условие задачи. Порой из-за неправильно прочитанного условия можно не решить даже самую легкую задачу.
Источники:
- «Сборник задач по химии», Г.П. Хомченко, И.Г. Хомченко, 2002.
- определить объем раствора
www.kakprosto.ru
Расчет количества вещества чистой жидкости
Если известна масса, то расчет аналогичен расчету для индивидуального твердого вещества.
Если известен объем жидкости, то
1 Найти массу этого объема жидкости:
mж = Vж·ρж,
где mж – масса жидкости г;
Vж – объем жидкости, мл;
ρж – плотность жидкости, г/мл.
2 Найти число молей жидкости:
.
Эта методика подходит для любого агрегатного состояния вещества.
Пример:
Определить количества вещества Н2О в 200 мл воды.
Решение: если температура не оговаривается, то плотность воды принимается 1 г/мл, тогда:
1
2
Расчет количества растворенного вещества в растворе,
Если известна его концентрация
Если известна массовая доля растворенного вещества, плотность раствора и его объем, то
1 Рассчитать массу раствора:
mр-ра = Vр-ра·ρр-ра,
где mр-ра– масса раствора, г;
Vр-ра – объем раствора, мл;
ρр-ра – плотность раствора, г/мл.
2 Рассчитать массу растворенного вещества
,
где — масса растворенного вещества, г;
— массовая доля растворенного вещества, выраженная в %.
3 Рассчитать число молей растворенного вещества
.
Пример:
Определить количество вещества азотной кислоты в 500 мл 10 % раствора кислоты плотностью 1,0543 г/мл.
1 Определить массу раствора
mр-ра = Vр-ра·ρр-ра = 500·1,0543 = 527,150 г.
2 Определить массу чистой HNO3
3 Определить число молей HNO3
Если известна молярная концентрация растворенного вещества и вещества и объем раствора, то
,
где — объем раствора, л;
— молярная концентрация i-го вещества в растворе, моль/л.
Расчет количества индивидуального
газообразного вещества
Если дана масса газообразного вещества, то рассчитывается по формуле (1).
Если дан объем, измеренный при нормальных условиях, — то по формуле (2), если объем газообразного вещества измерен при любых других условиях, — то по формуле (3),формулы приведены на страницах 6-7.
Газовые смеси
Газовые смеси всегда однородны (гомогенны). Каждый компонент газовой смеси имеет свой парциальный объем (Vi) и парциальное давление (Рi) .
Парциальным называют давление компонента газовой смеси, если бы компонент занимал весь объем газовой смеси, а другие компоненты отсутствовали.
Парциальным объемом называют объем, который занимал бы компонент газовой смеси, если его давление было равно давлению в газовой смеси, а другие компоненты отсутствовали.
Согласно закону Дальтона
Рсмеси = ΣРi; Vсмеси = ΣVi.
Состав газообразной смеси чаще всего выражается в объемных или мольных долях. Объемная доля (φi) – есть отношение парциального объема компонента к общему объему газовой смеси, а мольная доля (χi) – отношение количества вещества компонента к общему количеству вещества смеси:
Объемная и мольная доли могут быть выражены в долях единицы или в процентах. Для газовых смесей значения объемной и мольной доли одного и того же компонента равны.
Парциальное давление и объем компонента газовой смеси связаны с общим объемом и давлением следующие соотношениями:
Рi = Рсмеси· φi = Рсмеси· χi
Vi = Vсмеси· φi = Vсмеси· χi.
Парциальное давление и объем связаны с остальными параметрами газовой смеси через уравнение Менделеева-Клапейрона
Рi Vсмеси = ni R T,
Рсмеси·Vi = ni R T.
Средняя молярная масса смеси веществ в любом агрегатном состоянии может быть рассчитана из значений мольных долей составляющих компонентов.
Мсмеси = М1· χ1 + М2· χ2 +…+ Мn· χnили
Мсмеси = ΣМi· χi,
где Мi – молярная масса i-го компонента смеси, г/моль.
Для газовых смесей вместо мольных долей можно использовать объемные доли
Мсмеси = ΣМi· φi.
Примеры решения задач
Пример 1:[1]
Смесь оксидов углерода (II) и (IV) массой 48 г занимает объем 33,6 л (при н. у.). Рассчитайте объемы газов в смеси.
Решение:
Способ 1
Определить среднюю молярную массу смеси.
Можно воспользоваться следствием из закона Авогадро:
.
.
Можно рассчитать по уравнению Менделеева-Клапейрона
.
Определить состав смеси в объемных долях.
.
Пусть , тогда .
.
Следовательно , а .
Найти объем каждого компонента газовой смеси
.
.
Способ 2
Пусть в смеси содержится х молей СО и y молей СО2. Выразим объем и массу смеси через введенные переменные и составим систему уравнений
Следовательно:
Часто в инженерных расчетах нужно уметь пересчитывать состав газовой смеси из объемных процентов — в массовые, для этого необходимо рассчитать массу смеси и массу каждого компонента в отдельности.
Пример 2:
Определить массу 10 м3 газовой смеси состава: 21 % О2 и 79 % N2 при 50 °С и 100 кПа.
Решение:
Составы газовых смесей принято рассчитывать в объемных процентах, поэтому можно рассчитывать парциональные объемы кислорода и азота в смеси ( ).
,
.
Так как условия отличны от нормальных, то нужно найти количество вещества каждого компонента газовой смеси по формуле (3):
,
,
.
Найдем массу каждого компонента газовой смеси, решив ее относительно mi
,
.
Масса газовой смеси равна сумме масс ее компонентов
или .
Пример 3:
Определить металл, 0,54 г которого вытесняют из щелочи 0,743 л водорода, собранного над водой при температуре 17 °С и давлении 744,53 мм рт. ст.
Решение:
В задаче не известен металл, а, следовательно, и его степень окисления в соли, поэтому такую задачу удобно решать, используя закон эквивалентов.
По закону эквивалентов для водорода во всех реакциях , следовательно,
, но эквивалентный объем водорода изменен при н.у., а в задаче объем газа измерен при t = 17 °С и Ратм = 744,53 мм рт. ст. Кроме этого, в условии задачи сказано, что водород собирали над водой, следовательно, объем вытесненного газа представляет собой газовую смесь Н2 + Н2Опар, поэтому
,
где — давление насыщенного пара воды (см. приложение).
Пользуясь уравнением состояния идеального газа, привести объем водорода к нормальным условиям
,
где , , — давление водорода, объем и температура при н. у.
, , — парциальное давление водорода при температуре Т и в объеме газовой смеси V.
, тогда
.
Для t = 17 °С и =14,53 мм рт. ст. (см. приложение).
.
Рассчитать количество вещества эквивалента водорода.
.
Согласно закону эквивалентов
.
Найти молярную массу эквивалента металла
.
С другой стороны
= · .
Так как валентность металла неизвестна и в условии задачи не хватает данных для ее расчетного определения, то необходимо определить атомную массу металла путем перебора возможных валентностей. При переборе валентность не может быть более 4, а решением будет металл, который обладает амфотерными свойствами. Перебор удобнее представить в виде таблицы.
| валентность | ||||
| металл | Ве быть не может, т. к. у него нет валентности 1 | - | Al Решение задачи, у алюминия есть валентность 3, и он проявляет амфотерные свойства | - |
Пример 4:
Найти элемент, формулу его оксида, состав оксида в массовых долях, показать с помощью реакций его кислотно-основной характер, если известно, что на горение 1,44 г простого вещества израсходовано 0,672 л кислорода, приведенного к н. у.
Решение:
В этой задаче также не известен элемент и его степень окисления, но известен второй элемент – кислород, который в большинстве соединений проявляет степень окисления равную (-2), поэтому решать эту задачу удобно, используя закон эквивалентов.
,
,
где — объем прореагировавшего кислорода при н.у.;
— объем одного моль эквивалента кислорода.
,
экв.
экв,
экв.
следовательно, = экв,
а экв.
Определить массовые доли элементов в оксиде.
Способ 1
Пусть масса оксида равна m, а массовая доля элемента
1-х. Масса элемента в оксиде составит , а масса кислорода . Согласно следствию из закона эквивалентов
.
Подставить известные и выраженные через х величины
,
,
.
Следовательно, массовая доля кислорода в оксиде 0,4, а массовая доля элемента 0,6.
Способ 2
Найти массу кислорода, прореагировавшего с простым веществом
,
.
Масса оксида составит:
.
Рассчитать массовые доли элементов в оксиде.
,
.
Элемент определить аналогично примеру № 3, только для оксидов валентность элемента может быть от 1 до 8 включительно.
| валентность | ||||||||
| элемент | С | Mg | - | Ti | - | - | Kr | Мо |
| обсуждение | Быть не может, так как не проявляет в оксидах валентность 1 | Решение задачи | Решение задачи | Быть не может | Быть не может у, него нет валентности 8 |
Как видно из таблицы задача имеет два решения Mg и Ti.
Решение 1
Mg → валентность 2, оксид MgО, свойства – основные, т. е. оксид реагирует с кислотами и не реагирует с щелочами
MgО + 2НСl = MgСl2 + Н2О,
MgО + NaOH ≠
Решение 2
Ti – валентность 4, оксид TiО2, свойства амфотерные, т. е. оксид реагирует как с кислотами, так и с щелочами.
,
.
infopedia.su
❶ Как найти концентрацию 🚩 Наука 🚩 Популярное
Инструкция
Предположим, речь идет о сплаве. Например, бронза – сплав меди с оловом. Когда-то она имела такое значение, что в историю цивилизации вошла целая эпоха – «Бронзовый век». Итак, у вас имеется бронзовая деталь весом 1 кг, отлитая из сплава, содержащего 750 г меди и 250 г олова. Требуется найти концентрацию этих веществ. Здесь вам на помощь придет понятие «массовая доля», она же – «процентная концентрация». Как легко можно понять из самого названия, она выражается величиной, характеризующей отношение массы компонента к общей массе. 750/1000 = 0,75 (или 75%) – для меди, 250/1000 = 0,25 (или 25%) – для олова.А как быть в случае раствора? Вот, например, хорошо знакомая вам пищевая сода – бикарбонат натрия, NaHCO3. Предположим, 20 г этого вещества растворили в некотором количестве воды. Взвесив сосуд с раствором, и вычтя массу самого сосуда, получили массу раствора – 150 г. Как можно вычислить концентрацию раствора бикарбоната натрия?
Во-первых, посчитайте его массовую долю (или процентную концентрацию). Разделите массу вещества на общую массу раствора: 20/150 = 0,133. Или, переведите в проценты 0,133 * 100 = 13,3%.
Во-вторых, вы можете вычислить его молярную концентрацию, то есть посчитать, какое количество молей бикарбоната натрия находилось бы чему равен 1 моль этого вещества. Складывая атомные веса элементов, входящих в состав молекулы бикарбоната натрия (и не забывая при этом об индексах), получите его молярную массу: 23 + 1 + 12 + 48 = 84 г/моль.
То есть, если бы в 1 литре раствора содержалось бы 84 грамма этого вещества, у вас был бы 1-молярный раствор. Или, как принято записывать, 1М. А у вас – 20 грамм, к тому же в меньшем объеме. Учитывая, что плотность воды равна 1, для упрощения расчетов примите, что объем раствора составляет 130 мл (130 г + 20 г = 150 г, по условиям задачи). Небольшим изменением объема при растворении соли можно пренебречь, погрешность будет незначительной.
130 мл примерно в 7,7 раз меньше, чем 1000 мл. Следовательно, если бы в этом объеме содержалось 84/7,7 = 10,91 грамм бикарбоната натрия, это был бы 1М раствор. Но у вас 20 грамм вещества, следовательно: 20/10,91 = 1,83М. Вот такова молярная концентрация бикарбоната натрия в данном случае.
Полезный совет
Можно вычислить концентрацию, используя также понятия «мольная доля», «нормальность», «титр».
www.kakprosto.ru
